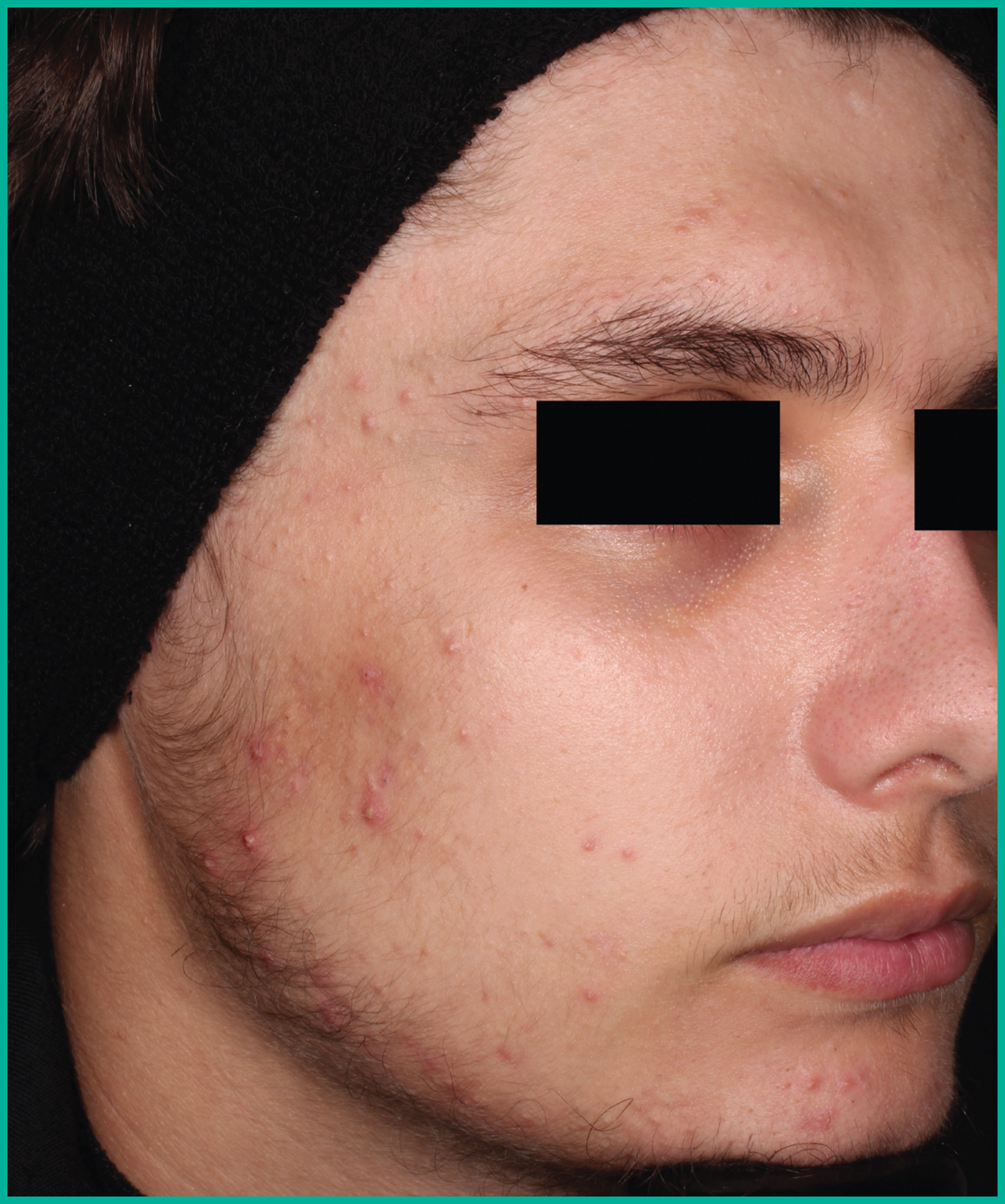
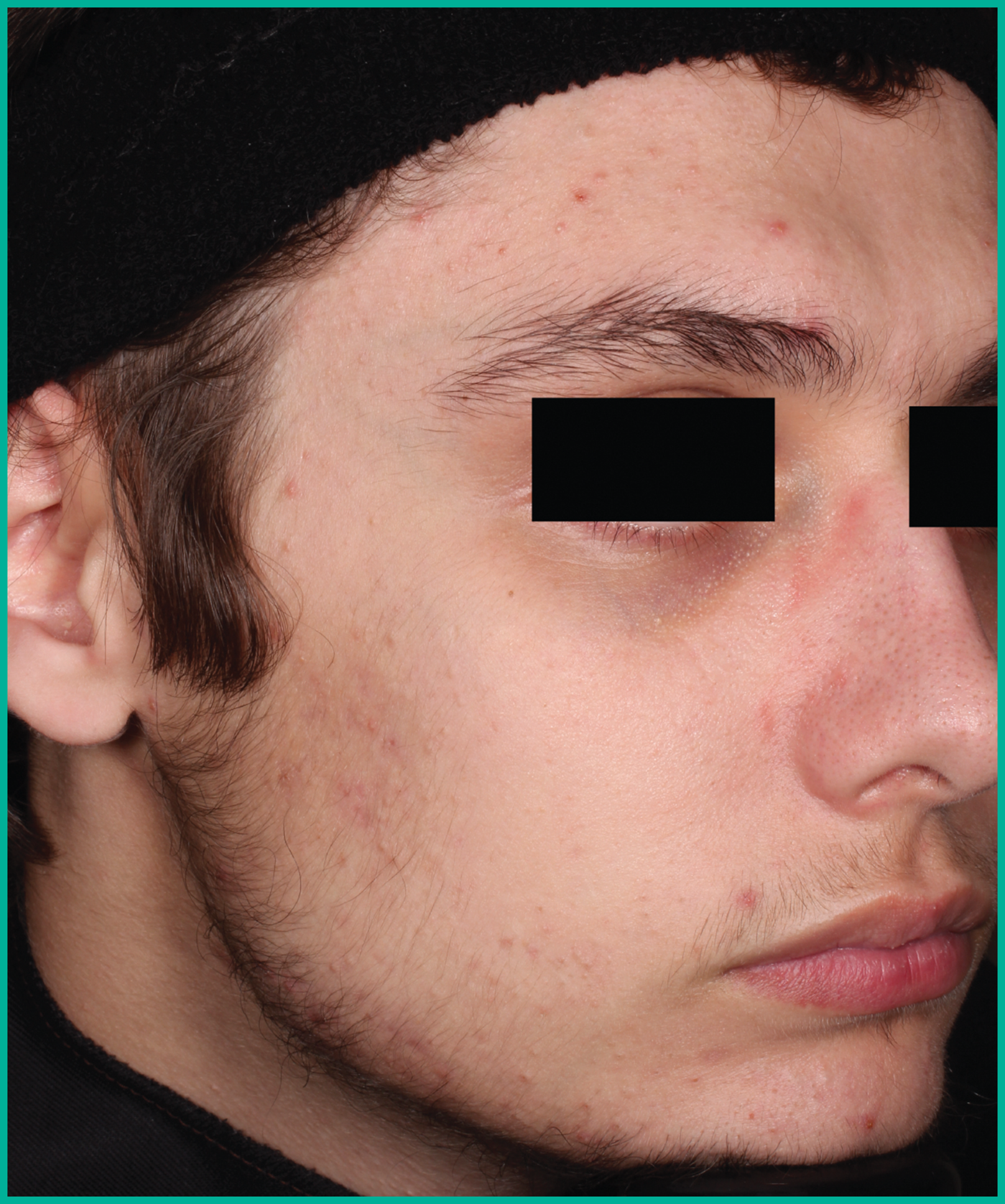
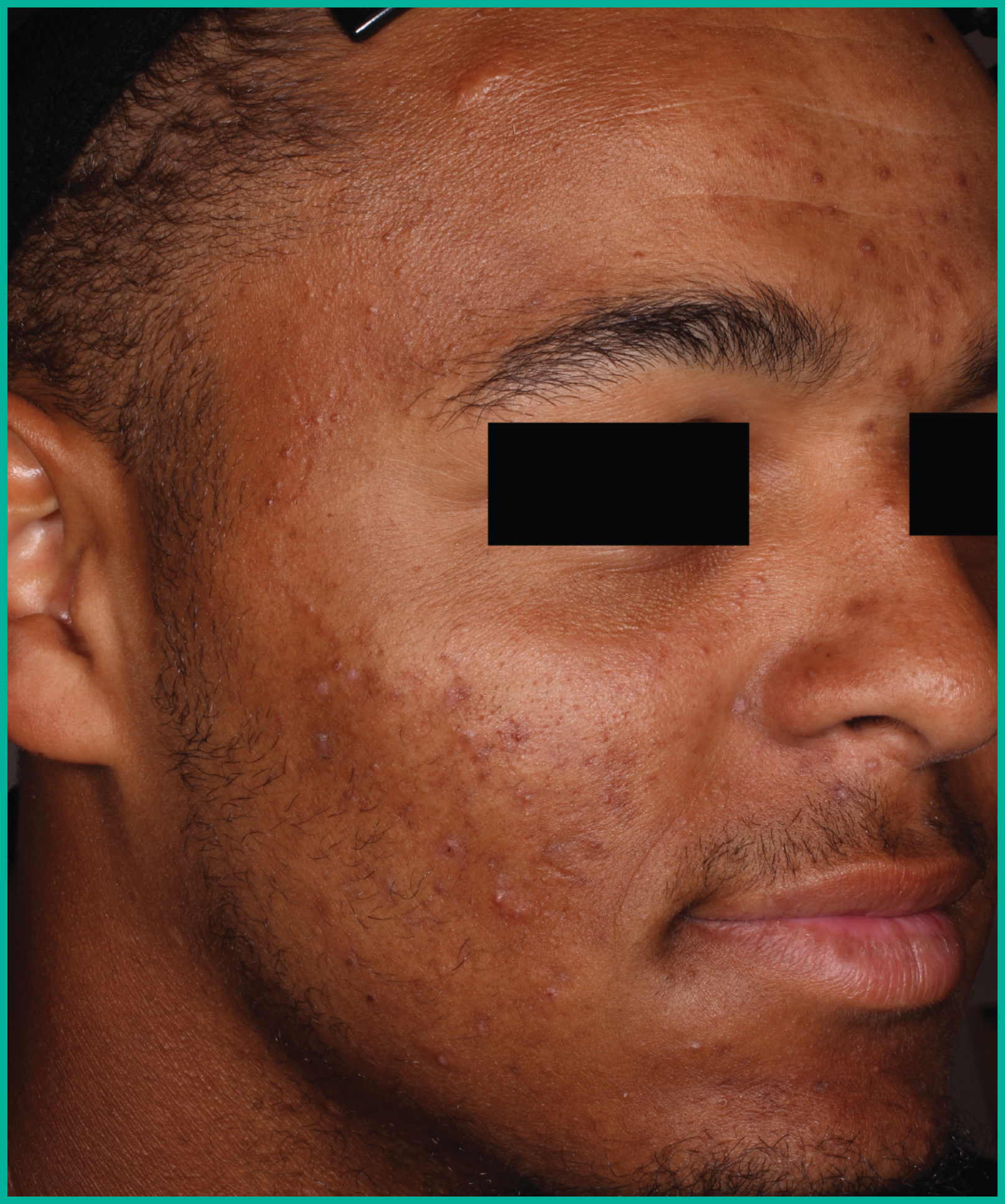
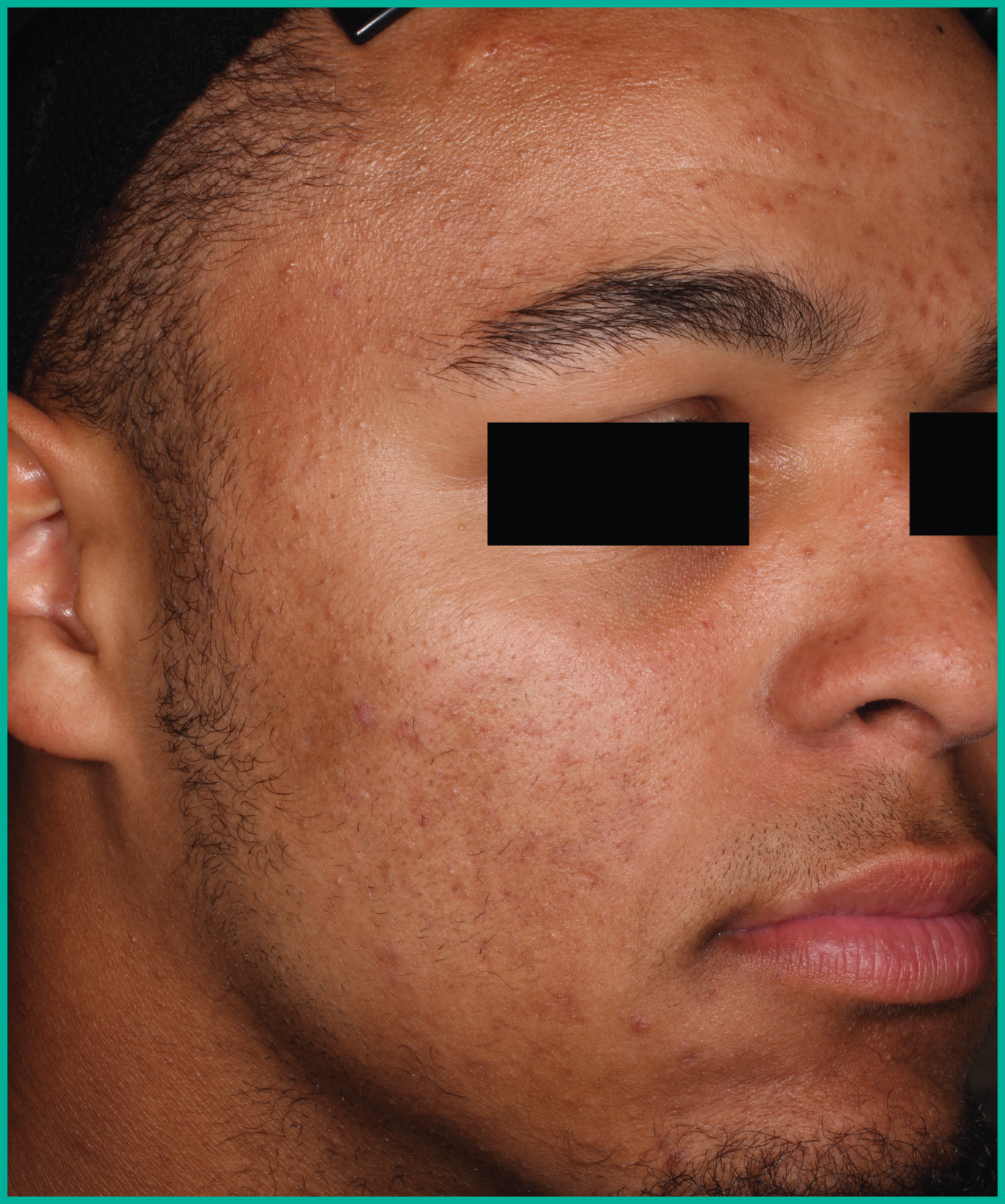
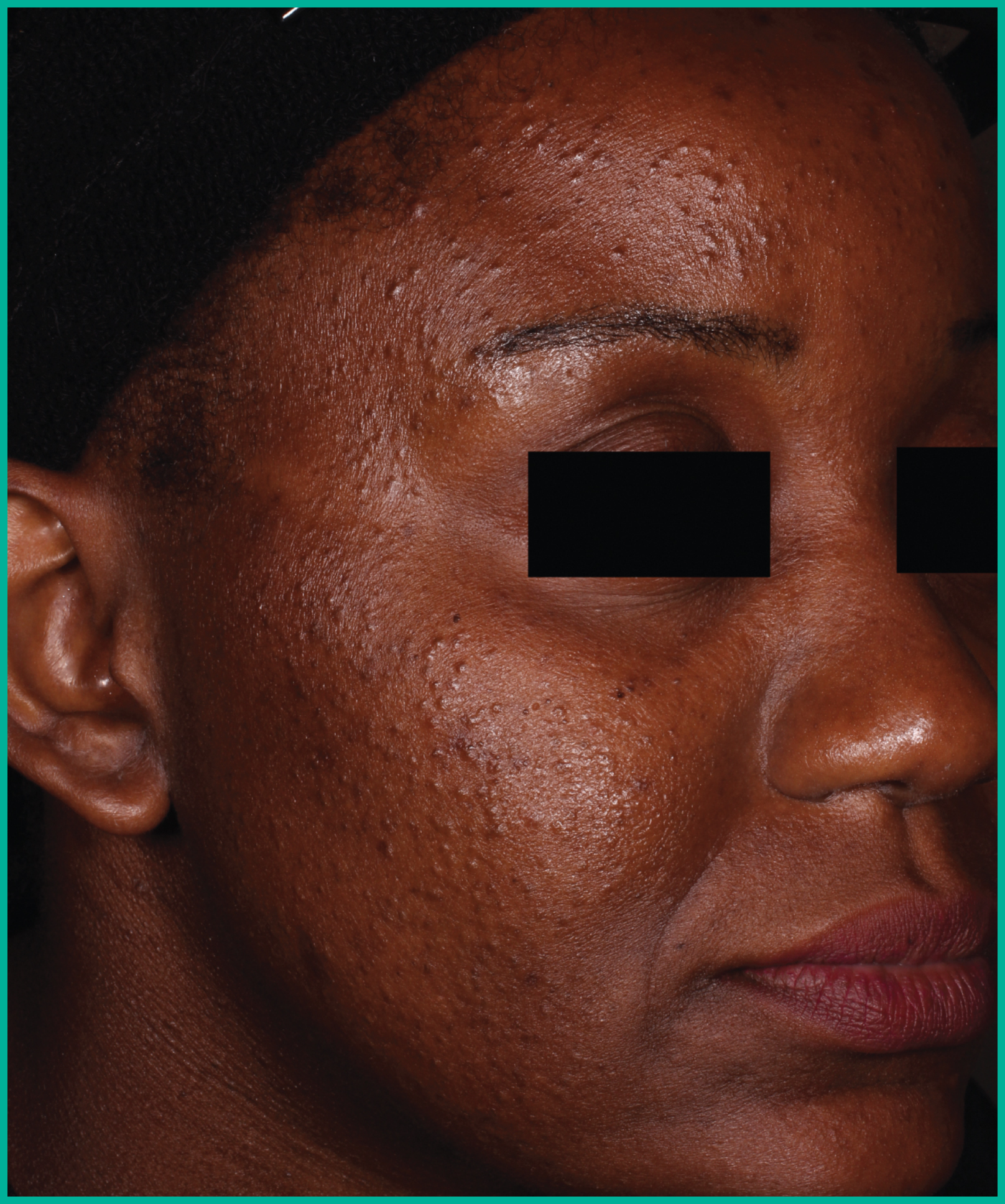
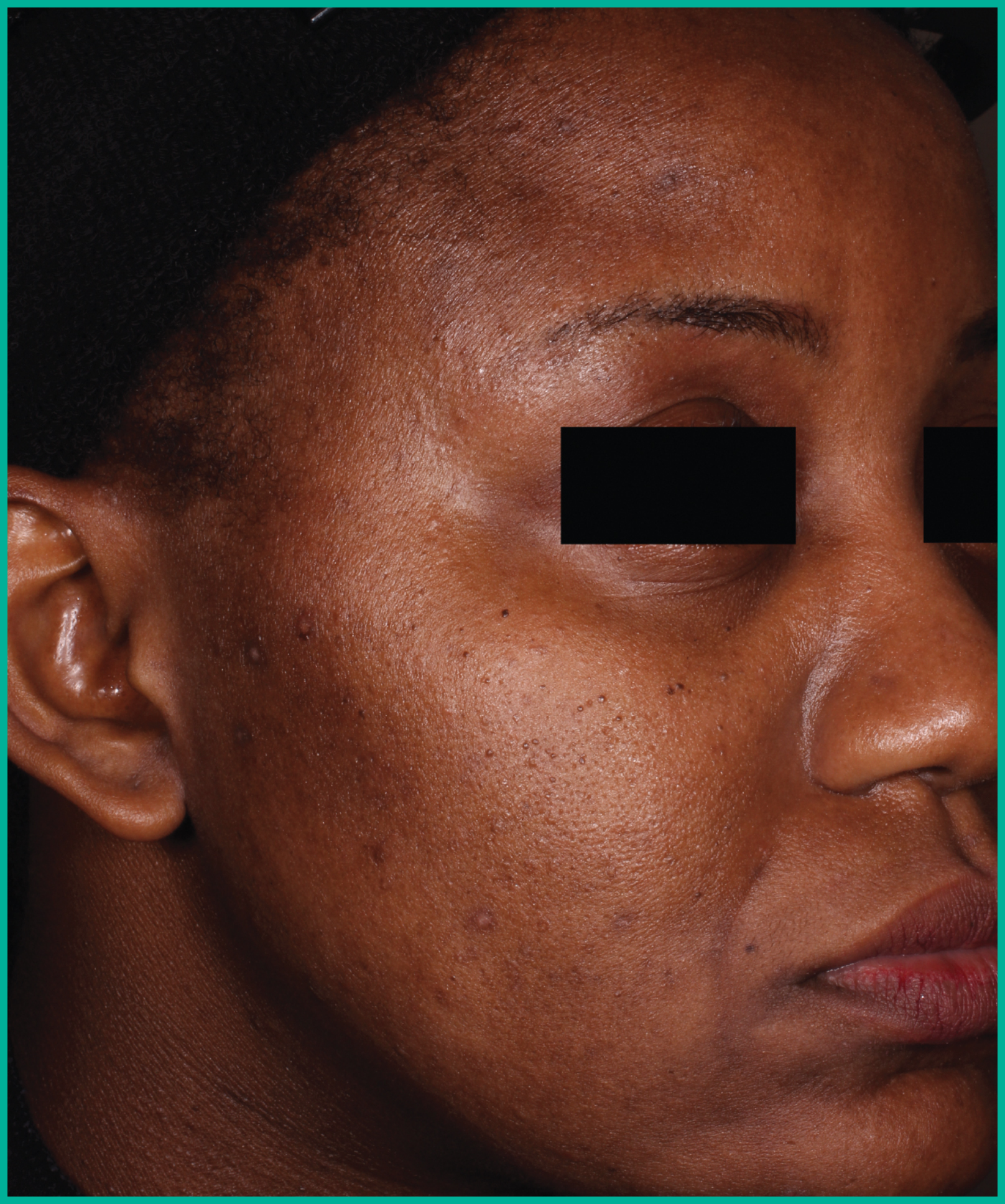
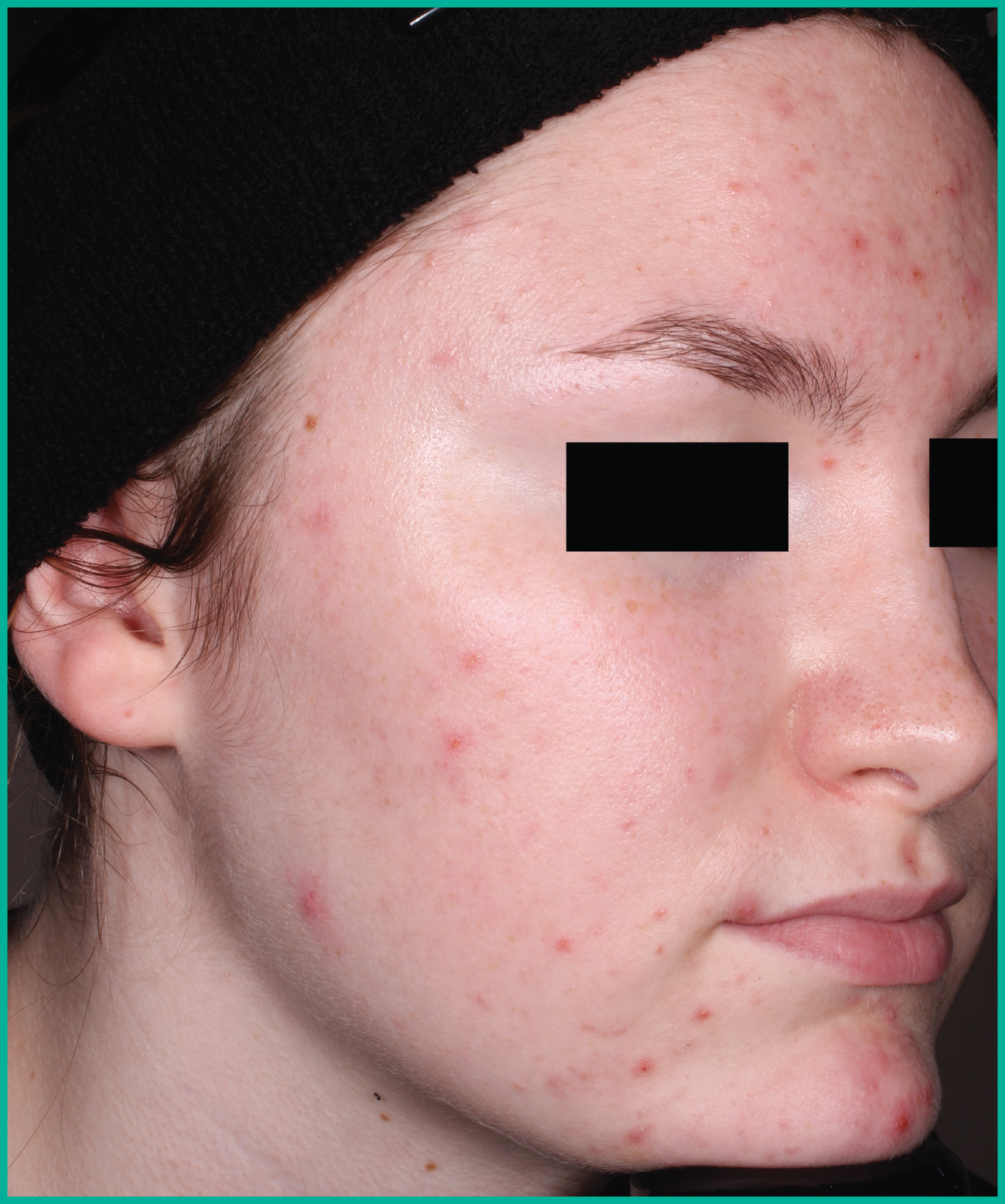
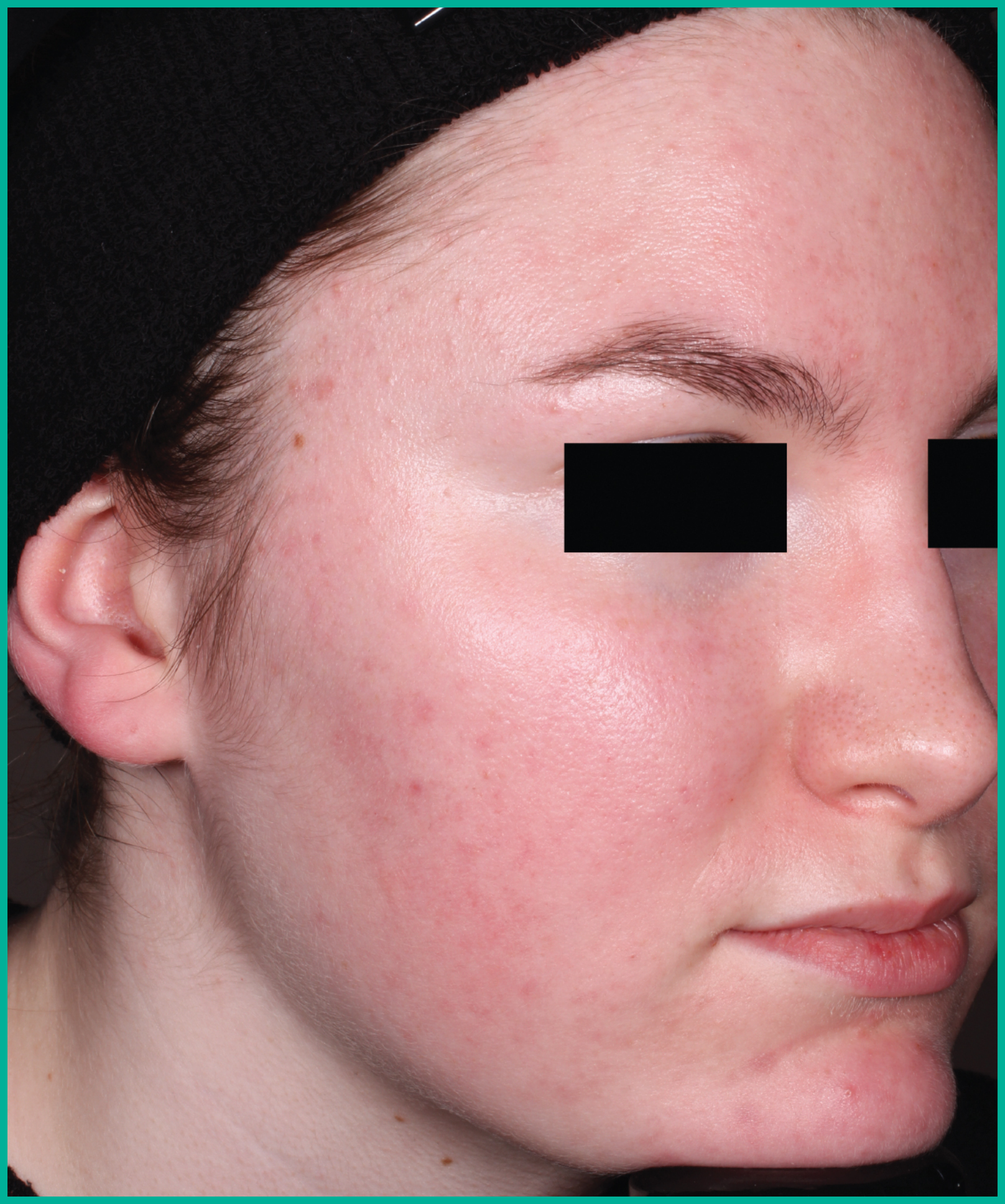
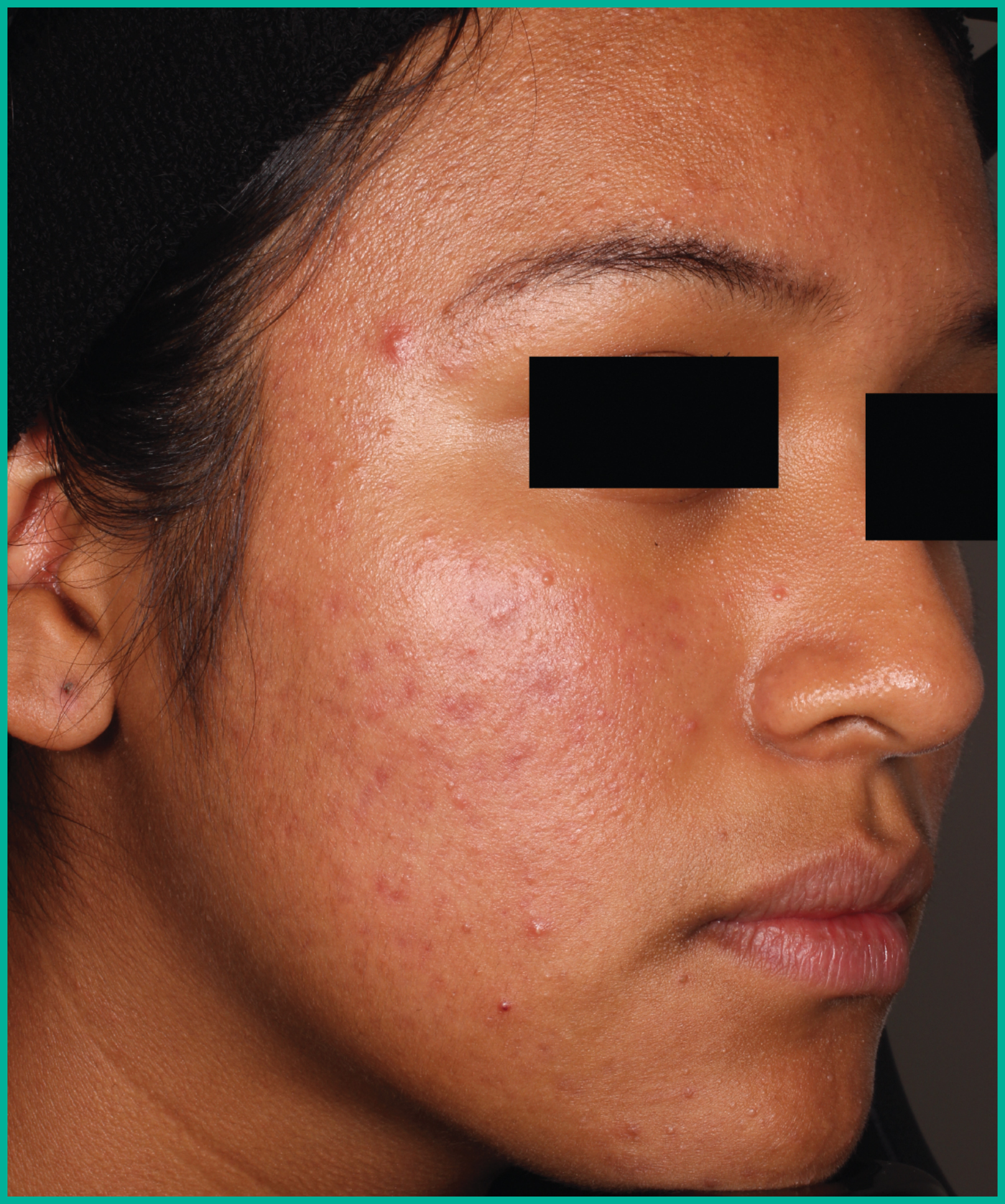
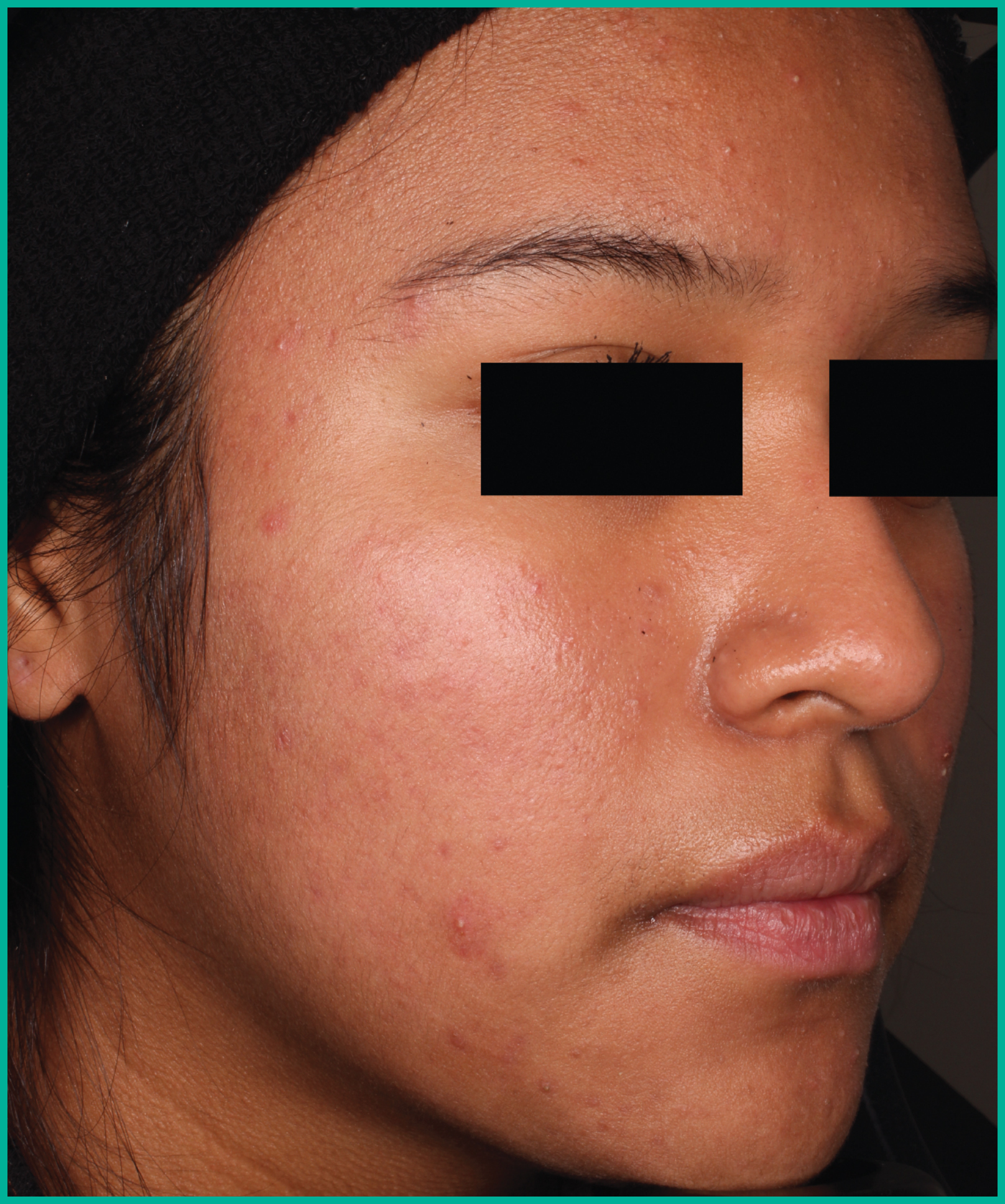
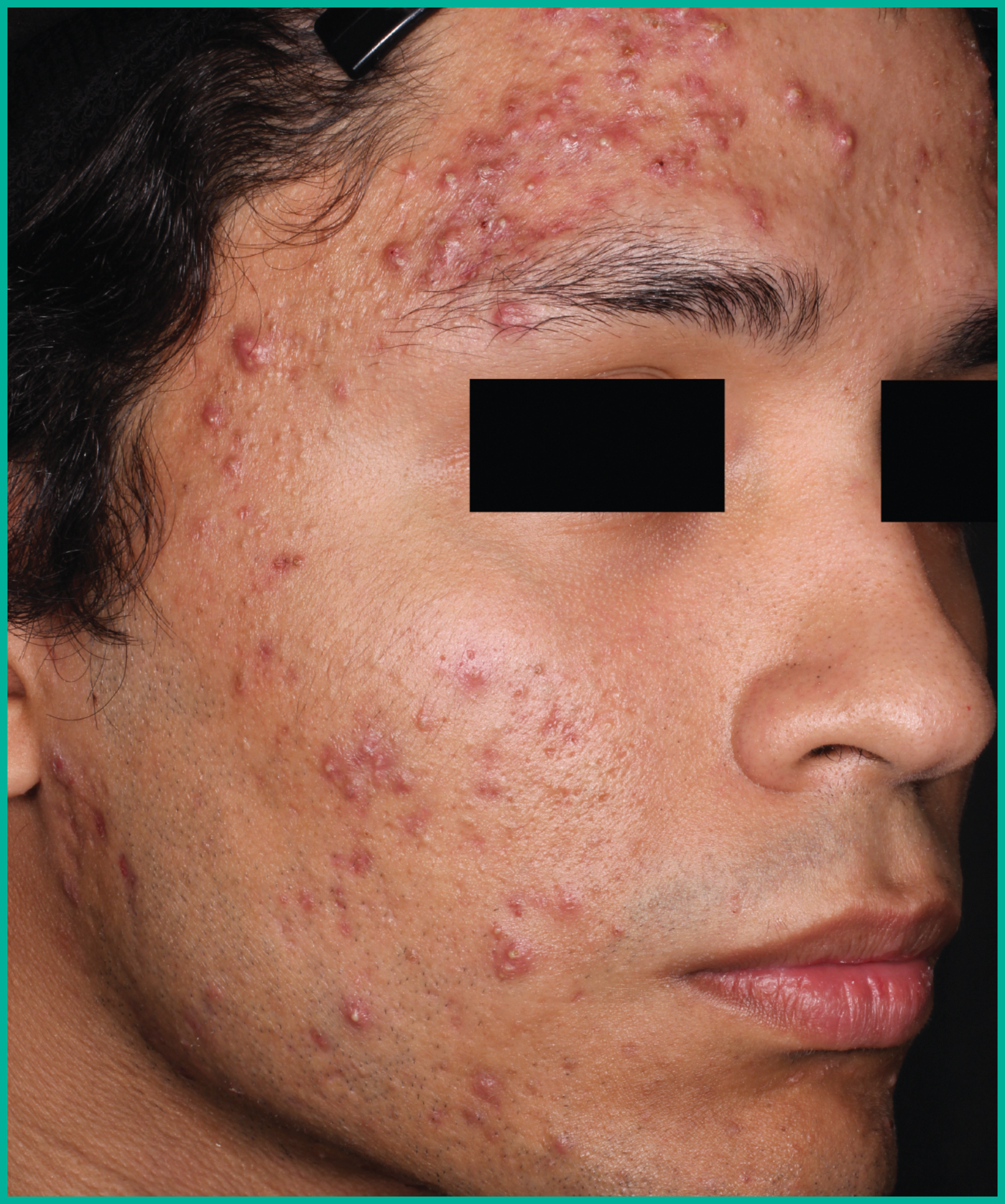
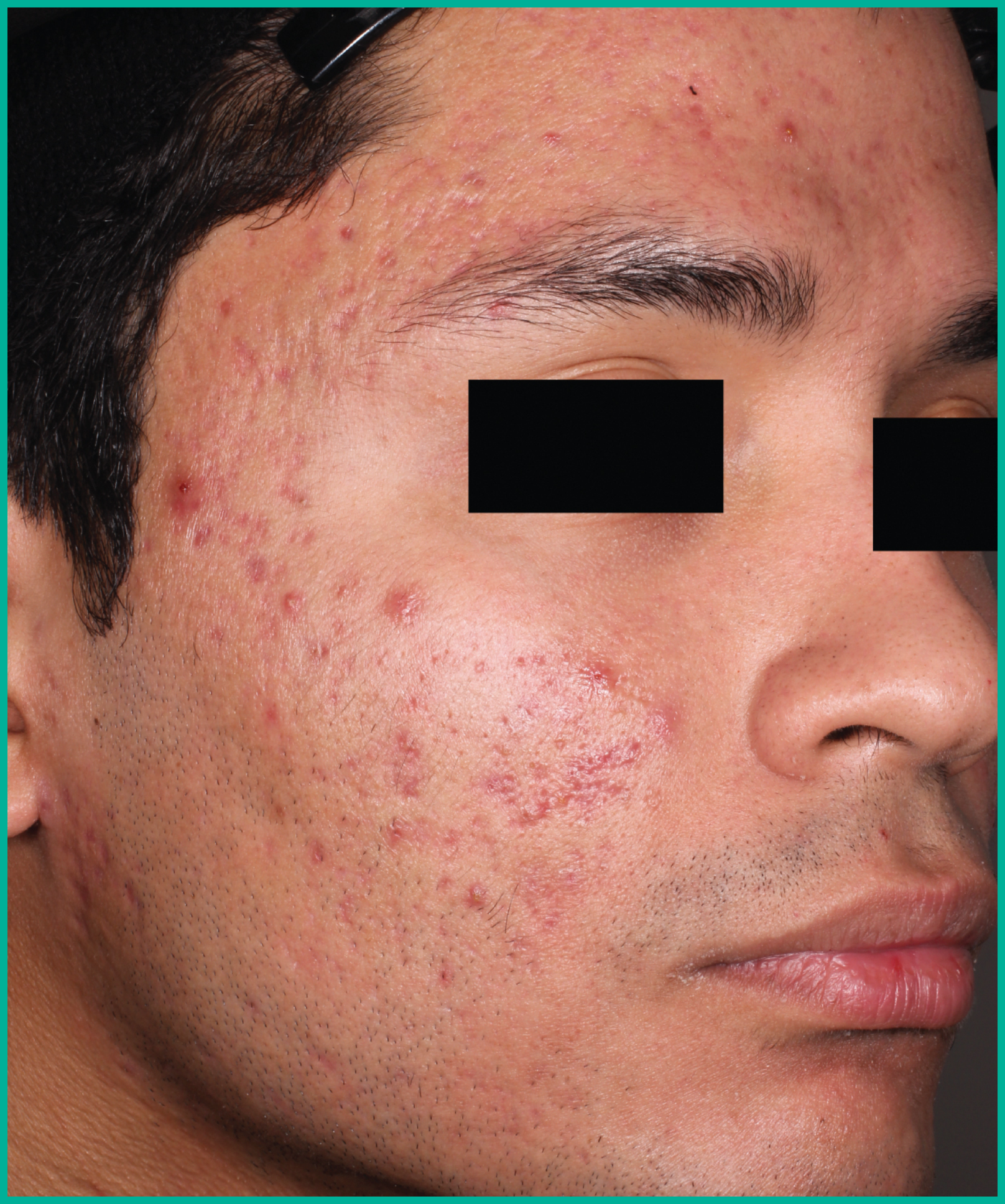
Traiter l’acné avec ARAZLO1
Résultats cliniques observés chez les patients des essais pivots2
Faites glisser les flèches pour vous déplacer d’une image à l’autre
Deux grandes études contrôlées par excipient menées auprès de plus de 1 600 patients au total*
ARAZLO s’est révélé efficace par rapport à l’excipient à la semaine 12 pour tous les critères d’évaluation co-principaux des deux études1*
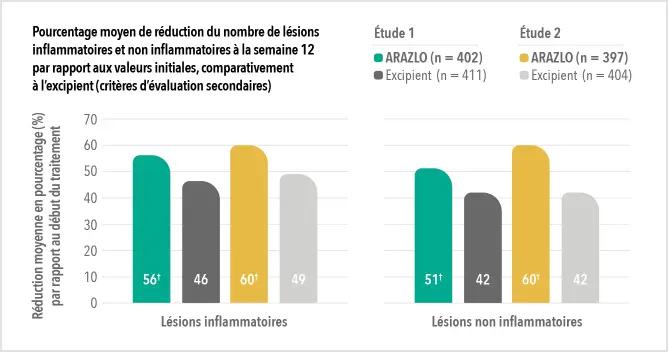
† p<0.001 vs. l’excipient.
D’après la monographie du produit.
Consultez la monographie du produit pour connaître tous les résultats sur l’efficacité du médicament.
Généralement bien toléré1
Dans deux essais cliniques de phase 3 groupés :
- 97,2 % (757/779) des patients ont poursuivi le traitement‡
- Les effets indésirables topiques fréquents d’ARAZLO (n = 779) étaient la douleur (5,3 %), la sécheresse (3,9 %), l’exfoliation (2,1 %), l’érythème (1,9 %) et le prurit (1,3 %) au site d’application.
Évaluations de l’innocuité et de la tolérabilité cutanées§
- Dans l’ensemble, l’incidence et les scores moyens de l’érythème, de la desquamation, de la sensation de brûlure, des picotements et des démangeaisons étaient plus élevés avec ARAZLO qu’avec l’excipient lors des visites suivant la visite initiale.
- Les symptômes étaient généralement d’intensité légère à modérée, et la gravité de ceux-ci a affiché des augmentations transitoires qui ont atteint un pic vers la semaine 2 et se sont atténuées au cours de l’essai.
À la semaine 12, la plupart des patients présentaient de faibles changements par rapport aux valeurs initiales pour presque tous les paramètres d’innocuité cutanée évalués.
Consultez la monographie du produit pour obtenir de plus amples renseignements sur l’incidence des paramètres d’innocuité et de tolérabilité cutanées.
* Dans deux essais cliniques de phase 3 identiques, prospectifs, à répartition aléatoire, multicentriques, à double insu, en groupes parallèles et contrôlés par excipient, la lotion ARAZLO (n = 402 et n = 397 dans les essais 1 et 2, respectivement) a été comparée à la lotion d’excipient (n = 411 et n = 404, respectivement) chez des patients de 9 ans et plus atteints d’acné modérée à grave. La variation en pourcentage du nombre de lésions inflammatoires et de lésions non inflammatoires aux semaines 12, 8 et 4 ainsi que la proportion de sujets présentant une réduction d’au moins 2 échelons à l’échelle EGSS (Evaluator’s Global Severity Score) à la semaine 12 comparativement aux valeurs initiales faisaient partie des critères secondaires.
‡ 2,8 % (22/779) des patients ont arrêté de prendre ARAZLO en raison d’effets indésirables survenus pendant le traitement.
§ Les paramètres d’innocuité et de tolérabilité cutanées (desquamation, érythème, hypopigmentation, hyperpigmentation, démangeaisons, sensation de brûlure et picotements) ont été évalués à chacune des visites. L’intensité des paramètres a été classée sur une échelle de 4 points (allant de 0 [nulle] à 3 [grave]).

Application uniquotidienne en 3 étapes simples1
Voici quelques conseils sur l’application d’ARAZLO qui vous permettront de mieux guider vos patients lorsque vous prescrivez ce produit.
Appliquer une mince couche d’ARAZLO (environ la grosseur d’un pois) pour couvrir les zones affectées sur une peau propre et sèche.
Pour une application sur le visage, appliquer des points sur le menton, les joues, le nez et le front, puis masser doucement sur tout le visage.
Au besoin, les patients peuvent utiliser un hydratant après avoir appliqué la lotion ARAZLO. Assurez-vous que les patients laissent sécher la peau après avoir appliqué la lotion ARAZLO.
Il faut éviter tout contact avec les yeux, la bouche, les plis paranasaux et les muqueuses. Si ARAZLO entre en contact avec les yeux ou se trouve près de ceux-ci, il faut rincer abondamment à l’eau. L’utilisation excessive d’ARAZLO ne permettra pas d’obtenir plus rapidement des résultats ou d’obtenir de meilleurs résultats et pourrait entraîner des rougeurs prononcées, de la desquamation ou de l’inconfort. Dans ce cas, il faut cesser l’utilisation du produit et attendre que la peau soit rétablie.
ARAZLO est exempt de parfum, de colorant et d’alcool.
Si l’utilisation concomitante d’ARAZLO et d’agents oxydants (p. ex. le peroxyde de benzoyle) est nécessaire, appliquez un produit le matin et l’autre le soir pour séparer le moment de l’application.
Au besoin, les patients peuvent utiliser un hydratant après avoir appliqué la lotion ARAZLO. Rappelez-leur de laisser suffisamment de temps à la peau pour sécher entre les applications.
Rappelez aux patients que les températures extrêmes, comme le vent ou le froid, peuvent être plus irritantes quand ils utilisent ARAZLO.
Évitez l’utilisation concomitante de médicaments et de cosmétiques qui ont un effet desséchant puissant; reportez le traitement par ARAZLO jusqu’à ce que les effets desséchants disparaissent.
L’exposition au soleil, y compris aux lampes solaires, doit être évitée. Avisez les patients d’utiliser des écrans solaires ayant un indice de protection d’au moins 15 et de porter des vêtements de protection.

Envisagez de réduire la fréquence d’application d’ARAZLO ou d’en cesser l’utilisation en cas de douleur, de sécheresse, d’exfoliation, d’érythème et de prurit au site d’application. Évitez l’application sur la peau eczémateuse ou brûlée par le soleil.

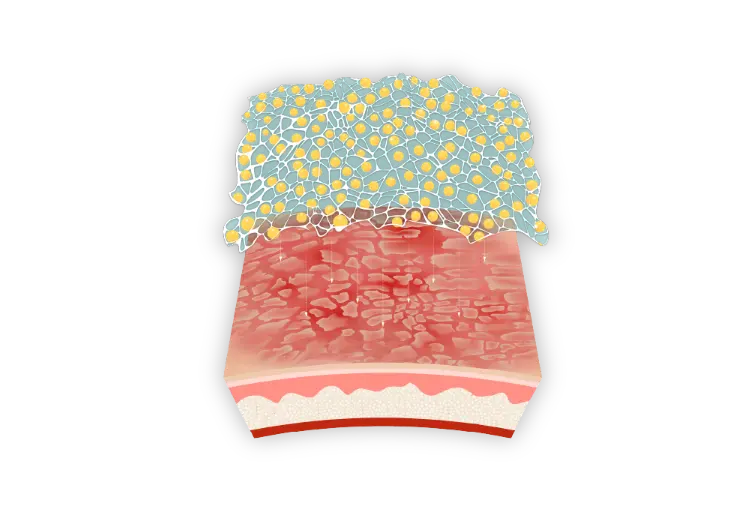
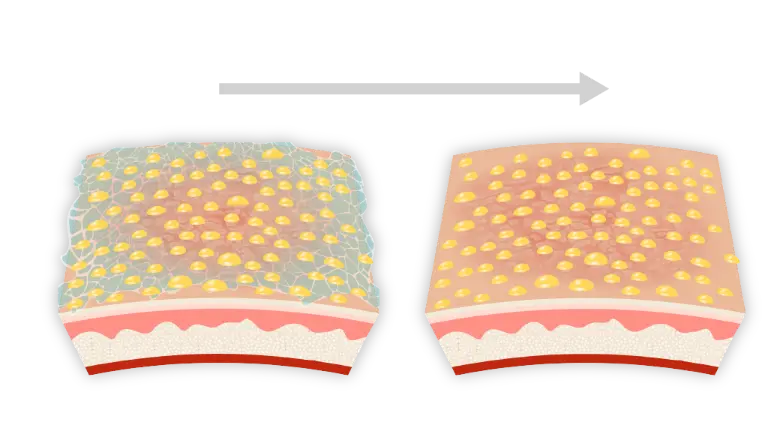
Aperçu détaillé de la technologie PRISMATREXMC1
Un excipient novateur, mis au point par Bausch Health, utilisé comme base pour la lotion ARAZLO
PRISMATREX est un maillage tridimensionnel qui assure la distribution des ingrédients actifs à travers sa matrice1,3,4*.
PRISMATREX a un pH cible (5,0 à 6,0) qui correspond au pH toléré par la peau sans causer d’irritation1*.
Ingrédients hydratants† qui peuvent atténuer la sécheresse de la peau1*.
* La signification clinique est inconnue. † Sébacate de diéthyle, huile minérale légère et solution de sorbitol.
ARAZLO est inscrit sur toutes les listes de médicaments provinciales5–15
Passez le curseur sur votre province pour voir les détails de l’inscription.
Tapez sur votre province pour voir les détails de l’inscription.
Également couvert sans restriction par les SSNA
| Province ou territoire | Type d’inscription |
|---|---|
| Colombie-Britannique | Autorisation spéciale |
| Alberta | Liste générale |
| Saskatchewan | Médicament sans restriction |
| Manitoba | Médicament sans restriction |
| Ontario | Usage restreint (code UR 636) Pour le traitement de l’acné vulgaire Période d’autorisation pour le médicament d’usage restreint : 1 an |
| Québec | Médicament d’exception Pour le traitement de l’acné (code DE20) |
| Terre-Neuve-et-Labrador | Autorisation spéciale |
| Nouvelle-Écosse | Couverture régulière pour les bénéficiaires âgés de 30 ans et moins Pour le traitement de l’acné vulgaire chez les bénéficiaires âgés de plus de 30 ans |
| Nouveau-Brunswick | Couverture régulière |
| Île-du-Prince-Édouard | Sans restriction |
| SSNA | Sans restriction |
Renseignements pour commander le produit
ARAZLO
Lotion de tazarotène à 0,045 % p/p
Format : 45 g
DIN : 02517868
Code du produit : 060752001762
CUP : 060752001762
- Chez les patients de 10 à moins de 12 ans, ARAZLO ne doit être appliqué que sur le visage.
- L’innocuité et l’efficacité d’ARAZLO n’ont pas été démontrées chez les personnes âgées (> 65 ans).
- Personnes enceintes ou susceptibles de le devenir
- Présence d’une dermatite séborrhéique
- Usage topique externe seulement
- Douleur, sécheresse, exfoliation, érythème et prurit au site d’application
- L’utilisation du tazarotène topique peut produire une dermatite de contact
- Éviter l’utilisation concomitante de médicaments et de cosmétiques qui ont un effet desséchant puissant
- Éviter l’application sur la peau eczémateuse ou brûlée par le soleil
- Photosensibilité
- Prudence si le patient prend également des médicaments connus comme photosensibilisateurs
- Les femmes en âge de procréer doivent utiliser des moyens de contraception adéquats
- Allaitement
Veuillez consulter la monographie du produit pour obtenir des renseignements importants sur les effets indésirables, les interactions médicamenteuses et la posologie qui n’ont pas été abordés dans le présent document.
Références : 1. Monographie d’ARAZLO. Bausch Health. 2. Données internes. Bausch Health. 3. Tanghetti EA, et al. J Dermatol Treat 2019; DOI: 10.1080/09546634.2019.1668907. 4. Metelitsa A, et al. Dermatology 2023;28(5):5-11. 5. Liste du Programme de médicaments de l’Ontario. Arazlo. Accessible au https://www.formulary.health.gov.on.ca/formulary/detail.xhtml?drugId=02517868. Consulté le 6 décembre 2023. 6. Saskatchewan Formulary Bulletin #222. Accessible au https://formulary.drugplan.ehealthsask.ca/Bulletins/Bulletin-0222-Nov-2022.pdf. Consulté le 6 décembre 2023.7. Régie de l’assurance maladie du Québec. Liste des médicaments. Accessible au https://www.ramq.gouv.qc.ca/sites/default/files/documents/non_indexes/liste_med_2023-11-08_fr.pdf. Consulté le 6 décembre 2023. 8. Alberta Health. Liste interactive des médicaments. Accessible au https://idbl.ab.bluecross.ca/idbl/drugDetails?_cid=39f1a0f1-0258-4f1a-86c9-eb8410f099e2&id=0000099458&intchg_grp_nbr=1&detailId=7749973. Consulté le 6 décembre 2023. 9. Services de santé non assurés. Liste des médicaments. Accessible au https://nihb-ssna.express-scripts.ca/en/0205140506092019/16/160407. Consulté le 6 décembre 2023. 10. Manitoba Drug Benefits and Manitoba Drug Interchangeability Formulary Amendments. Accessible au https://web22.gov.mb.ca/eFormulary/searchResults.aspx?query=arazlo&type=basic. Consulté le 6 décembre 2023. 11. Liste des médicaments de la Nouvelle-Écosse. Accessible au https://novascotia.ca/dhw/pharmacare/documents/formulary.pdf. Consulté le 6 décembre 2023. 12. Santé Î.-P.-É. Liste des médicaments couverts par le Régime d’assurance-médicaments de l’Î. P. É. Accessible au https://www.princeedwardisland.ca/sites/default/files/publications/pei_pharmacare_formulary.pdf. Consulté le 6 décembre 2023. 13. Formulaire pour les régimes de médicaments du Nouveau-Brunswick, novembre 2023. Accessible au https://www2.gnb.ca/content/dam/gnb/Departments/h-s/pdf/en/NBDrugPlan/NewBrunswickDrugPlansFormulary.pdf. Consulté le 6 décembre 2023. 14. Base de données des produits du programme de médicaments sur ordonnance de T.-N.-L. Services de santé et services communautaires. Terre-Neuve-et-Labrador. Accessible au https://www.health.gov.nl.ca/health/prescription/class_search_nl.asp?din=02517868&GReturn=GenericName&Subtitle1=Generic%20or%20Brand%20Name%20:%20%20%20&Subtitle2=arazlo. Consulté le 15 décembre 2023. 15. BC PharmaCare Limited Drug Coverage Program. BC PharmaCare. Accessible au https://www2.gov.bc.ca/gov/content/health/practitioner-professional-resources/pharmacare/programs/limited-coverage-drug-program/limited-coverage-drugs-page-tazarotene-topical. Consulté le 12 avril 2024.